騰盛博藥發佈2022年度全年財務業績及公司最新進展
 |
公司始終以開發針對乙型肝炎病毒(HBV)感染的新型功能性治癒方案,以及針對產後抑鬱症(PPD)和重度抑鬱症(MDD)的潛在首創治療方案為核心臨床項目
預期在2023年獲得多項2a期驗證性(POC)臨床數據結果並啟動多項2b期臨床試驗
充足的資金將至少支持公司運營到2025年底
公司將於今日晚間8:00(香港時間)/上午8:00(美國東部時間)召開電話會議
北京和北卡羅萊納州達勒姆市2023年3月24日 /美通社/ -- 騰盛博藥生物科技有限公司Brii Biosciences( 「騰盛博藥」或「公司」,股票代碼:2137.HK),一家致力於針對患者需求未被滿足的疾病開發治療方案,以改善患者健康狀況和治療選擇的生物技術公司,今日發佈了最新公司進展和截至2022年12月31日的全年業績報告。
「2022年,我們實現了多個重要臨床、商業化和企業發展的里程碑,進一步增強了公司代表患者利益應對重大公共衛生挑戰的整體地位。」騰盛博藥董事長兼首席執行官洪志博士表示:「展望今年,我們將繼續致力於在中國開發乙肝功能性治癒療法,以及在美國開發針對產後抑鬱和重度抑鬱的潛在首創療法,為推進這兩項首要臨床開發項目奠定穩定基礎。此外,在我們豐富的傳染性疾病和中樞神經系統疾病產品組合中,我們期待繼續促進全新的一流合作夥伴關係,同時將我們成熟的內部研發能力應用到公司戰略塑造和定位上,以實現公司的長期增長和成功。」
除首要的HBV和PPD與MDD臨床項目外,騰盛博藥及其合作夥伴正在推進一條由十餘種差異化療法組成的豐富產品管線,包括焦慮障礙和重度抑鬱症、人類免疫缺陷病毒(HIV)感染、多重耐藥(MDR)和廣泛耐藥(XDR)革蘭氏陰性感染,及非結核分枝桿菌(NTM)肺病。
此外,公司已決定結束新冠中和抗體安巴韋單抗和羅米司韋單抗聯合療法項目,並已停止其生產工作以將資源重新轉向核心項目。這一決定是基於不斷演變的新冠疫情趨勢和相關政策的更新,以及被拖延的公司受托生產企業的現場監管核查。
2022財年及近期公司進展
- 騰盛博藥擴大高管領導隊伍,強化其董事會架構和公司發展舉措,包括首席戰略官及財務官李安康博士委任加入董事會擔任執行董事並擔任戰略委員會主席,委任楊台瑩博士為董事會獨立非執行董事,並擔任審計及風險委員會聯席主席。公司高管團隊的其他新晉成員包括:首席業務官Susannah Cantrell博士、首席技術官Eleanor de Groot博士、中樞神經系統(CNS)疾病治療領域負責人Aleksandar Skuban博士及首席人才官Karen D. Neuendorff女士。
- 騰盛博藥強化中國高管團隊,包括委任朱青博士擔任中國研發負責人及梁旭先生擔任大中華區總經理。
- 騰盛博藥獲選納入MSCI中國小型股指數,其是全球機構投資者尋求優化投資組合的基準。
- 騰盛博藥的長效新冠中和抗體安巴韋單抗和羅米司韋單抗聯合療法在中國商業化上市。
- 騰盛博藥繼續深化與美國各主要的孕產婦健康倡導團體的交流,以此更深入地瞭解患者需求及偏好,包括支持產後支持國際聯盟組織(Postpartum Support International)的 「走出黑暗」 (Climb Out of the Darkness)系列活動、主辦20/20 Mom 年度論壇、關心孕產媽媽健康就在此刻(Maternal Mental Health Now)、第35屆產後支持年度國際會議(Annual Postpartum Support International Conference),及2022年黑人產婦和精神健康峰會(Black Maternal & Mental Health Summit)。
- 騰盛博藥憑借其在企業發展和臨床開發方面的成就不斷獲得業界的廣泛認可,上榜十多個獎項和專題獎項名單,包括:福布斯中國「2022年度中國科技女性50榜」、華夏時報「2022年度生物科技創新獎」、E藥經理人「2022中國醫藥上市公司最具ESG投資價值TOP 10」、美國精神衛生協會「2022-2023年度工作場所精神健康金獎」等。騰盛博藥還榮獲MSCI ESG評級的 "A"級,該評級是全球公認的用於衡量企業應對長期環境、社會及公司治理(ESG)風險的應變能力的指標。
2022財年臨床管線亮點和未來里程碑
乙型肝炎病毒(HBV)項目(中國團隊核心項目)
由騰盛博藥中國團隊和合作夥伴Vir Biotechnology, Inc.( "Vir" ,納斯達克股票代碼:VIR),和VBI Vaccines, Inc. ( "VBI" ,納斯達克股票代碼:VBIV)主導,公司正在推進多項HBV聯合療法研究,以提高中國的慢性HBV患者功能性治癒的水平。中國是世界上HBV感染率最高的國家,有8,700萬人受到該疾病的影響,但目前並無有效的功能治癒療法。
- BRII-179(VBI-2601)和BRII-835(VIR-2218 )聯合療法(由騰盛博藥開展的研究)
- 2023年2月,騰盛博藥在2023年亞太肝臟研究學會(APASL)會議上以口頭報告形式公佈了中期結果,數據顯示該聯合療法安全且耐受性良好,與單獨使用BRII-835(VIR-2218)或BRII-179(VBI-2601)相比,該聯合療法誘導了更強的抗乙型肝炎病毒表面抗原(HBsAg)抗體應答,並改善了HBsAg特異性T細胞應答。在APASL會議上展示的數據中,所有隊列的50名受試者在治療結束時都實現了HBsAg降低,平均降低-1.7至-1.8 log10 IU/mL。此外,第40周時觀察到在聯合治療隊列中2例受試者HBsAg水平最低降至或低於定量下限(LLOQ),同時觀察到穩健的HBsAg特異性抗體應答和T細胞應答。
- 預計在2023年下半年公佈更多該聯合療法2期研究數據。
- BRII-179(VBI-2601)和聚乙二醇化干擾素-α(PEG-IFN-α)聯合療法(由騰盛博藥開展的研究)
- 2022年12月,公司完成了一項2期聯合試驗第一部分的患者入組,該試驗旨在對已接受聚乙二醇干擾素α(PEG-IFN-α)和核甘酸/核甘逆轉錄酶抑制劑(NRTI)治療的慢性HBV患者中繼續增加BRII-179(VBI-2601)的給藥進行評估。
- 預計將在2023年下半年公佈該聯合療法的初步數據。
- VIR-2218(BRII-835)和PEG-IFN-α聯合療法 (由Vir開展的研究)
- Vir在美國肝病研究協會(AASLD)2022年會議上公佈了正在進行的該聯合用藥48周的2期試驗數據,數據顯示約31%的慢性HBV感染患者在治療結束時達到HBsAg血清清除伴抗乙肝表面抗原血清轉換,且無新安全性信號。
- 預計在2023年上半年公佈該聯合療法的2期研究數據。
- VIR-2218(BRII-835)和 VIR-3434(BRII-877)聯合療法(由Vir開展的MARCH研究)
- 2022年11月,Vir在美國肝病研究協會(AASLD)肝臟年會® 上公佈了其正在進行的2期MARCH研究的A部分治療結束初步數據,以評估接受NRTI療法的慢性HBV感染患者接受VIR-2218 (BRII-835) 和VIR-3434 (BRII-877) 聯合用藥的情況。數據表明該聯合方案中患者的HBsAg水平進一步降低,所有患者的HBsAg水平較單用其中一種藥物有更大降幅,且無安全隱患信號。
- 預計在2023年上半年,Vir公佈該聯合療法MARCH試驗A部分的更多數據。
- 預計在2023年下半年,Vir就正在進行的2期MARCH試驗B部分將公佈VIR-2218 (BRII-835) 和VIR-3434 (BRII-877) 與PEG-IFN-α聯用或不與PEG-IFN-α聯用的初步數據。
- 騰盛博藥正與國家藥品監督管理局(NMPA)藥品審評中心(CDE)進行討論,以在中國啟動BRII-877 (VIR-3434)的1期臨床研究。
產後抑鬱症(PPD)項目和重度抑鬱症(MDD)(美國團隊核心項目)
騰盛博藥正在自主研發BRII-296。作為首創的一次性注射治療候選藥物,該療法有可能改善美國患者的PPD及MDD治療前景。
- BRII-296
- 2022年9月,騰盛博藥宣佈了BRII-296 的1期研究的積極頂線結果。數據表明,單次注射600 mg的BRII-296展示了良好的藥代動力學(PK)特徵,在健康受試者中安全且耐受性良好。醫生和患者群體的早期反饋正向積極,這增強了其作為PPD首創單次注射治療方案的潛力。
- 騰盛博藥正與美國藥品監督管理局(FDA)密切討論,就PPD治療方案達成一致,為2期POC研究做準備。
- 2023年,公司將積極致力於擴大BRII-296的其他臨床適應症,並計劃在2023年年底前在美國啟動更多的2期研究。
- BRII-297
- 騰盛博藥已開展将BRII-297用於各種焦慮障礙和抑鬱症的新藥臨床試驗 (IND) 籌備研究。
- 騰盛博藥計劃於2023年上半年在澳大利亞啟動BRII-297的首次人體試驗的PK、安全性及耐受性研究。
其他臨床和臨床前開發更新
人類免疫缺陷病毒(HIV)項目
- BRII-732
- 2022年10月,騰盛博藥公佈了1期研究的積極數據,顯示BRII-732表現出可接受的安全性和耐受性特徵,以及在健康志願者中達到治療目標的良好線性藥代動力學特徵,這些數據加強了BRII-732作為每週一次口服療法治療HIV感染的潛力。
- 2022年12月,騰盛博藥收到通知,美國FDA已解除針對公司BRII-732的1期研究的臨床試驗暫停,以較低劑量開展BRII-732每週口服給藥一次的研究。公司正在探索外部合作機會,以繼續開發BRII-732作為HIV患者潛在的每週口服一次的長效聯合治療方案。
- BRII-753
- 公司篩選了一種新的臨床候選藥物BRII-753作為皮下注射的長效療法,旨在擴充給藥計劃,或可進行每月一次、每季度一次或每半年一次給藥。
- BRII-778
- 基於一項已完成的1期研究的PK數據,騰盛博藥已決定停止BRII-778的後續開發。
多重耐藥和廣泛耐藥(MDR/XDR)革蘭氏陰性菌感染項目
- BRII-693 (QPX-9003)
- 2022年初,Qpex Biopharma, Inc. (Qpex)宣佈BRII-693獲得美國FDA 授予合格傳染病產品(QIDP)的資格認定。
- 2022年10月,Qpex在IDWeek上公佈了其已完成的首次人體臨床研究的1期中期結果,數據表明在所有測試的劑量中,BRII-693安全且耐受性良好,並支持繼續開發BRII-693用於治療對碳青霉烯類耐藥的鮑曼不動桿菌和銅綠假單胞菌感染。
- Qpex繼續與美國FDA緊密溝通,以調整其下一步的臨床開發工作。
- 騰盛博藥計劃在2023年上半年向NMPA提交在中國開發BRII-693的IND前申請。
- BRII-672 (ORAvance™)
- 2022年初,Qpex宣佈BRII-672與一未被披露的口服β-內酰胺類抗生素聯合療法獲美國FDA 授予QIDP資格認定。
- Qpex在2022年10月的IDWeek上公佈了BRII-672的臨床前數據和1期臨床中期結果。
- 2022年四季度,Qpex在美國已完成首次人體1期研究。無受試者因不良事件(AE)終止治療,且在單劑量爬坡(SAD)研究中並無出現嚴重不良事件(SAE)。
- 2022年12月,騰盛博藥向NMPA提交IND前申請,以在中國尋求有關BRII-672開發計劃的相關註冊指引。
- Qpex將繼續與美國FDA緊密溝通,以調整其下一步的臨床開發工作。
- BRII-636 (OMNIvance®)
- 2022年初,Qpex宣佈BRII-636獲美國FDA 授予QIDP資格認定。
- Qpex已完成首次人體1期研究和藥物相互作用研究,並在2022年四季度的IDWeek上公佈了結果。1期多劑量爬坡(MAD)研究表明,BRII-636(xeruborbactam)在單用和與美羅培南聯合用藥的情況下,其整體耐受良好,劑量與療效相關性與之前在動物感染模型中的結論一致。
- Qpex將繼續與美國FDA緊密溝通,以調整其臨床開發的下一步工作。
非結核分枝桿菌項目
- BRII-658 (epetraborole)
- 騰盛博藥的合作夥伴AN2 Therapeutics, Inc.(納斯達克股票代碼:ANTX)正在推進由鳥分枝桿菌復合體 (MAC)引起的難治性肺病的關鍵性2/3期臨床試驗。
- AN2已完成並報告了其1期橋接性研究的頂線結果,該研究旨在評估日本受試者口服epetraborole的PK、安全性和耐受性。
新型冠狀病毒肺炎(COVID-19 )項目
- 繼2022年7月安巴韋單抗和羅米司韋單抗聯合療法商業化上市後,騰盛博藥已基本將該藥物的全部適銷產品銷售到全國25個省份的358家醫院,獲得收入約人民幣5,160萬元。作為我們確保人道主義援助和協助控制疫情爆發承諾的一部分,公司在該抗體藥物商業化上市前已向全國多達21個城市的22家醫院捐贈了近3,000人份的抗體用於緊急救治。
- 2023年1月,在《新型冠狀病毒感染診療方案(試行第十版)》及《新型冠狀病毒感染重症病例診療方案(試行第四版)》中,安巴韋單抗和羅米司韋單抗聯合療法被推薦為抗新冠病毒療法。
- 公司已決定結束安巴韋單抗和羅米司韋單抗聯合療法項目,並已停止生產工作以將資源重新轉向核心項目。這一決定是基於不斷演變的新冠疫情趨勢,和美國衛生和公共服務部(HHS)計劃於2023年5月結束新冠肺炎聯邦公共衛生緊急狀態(PHE),以及被拖延的公司受托生產企業(CDMO)的現場監管核查。公司正在與美國FDA溝通,在完成所有監管要求後,將在適當的時候撤回緊急使用授權(EUA)申請,並會與中國NMPA進一步溝通,在2023年三季度完成監管機構的各項要求後,撤回生物製品許可申請(BLA)。公司預計未來無論在中國或美國以及其他地區,不會再從該聯合療法中產生可觀收入。
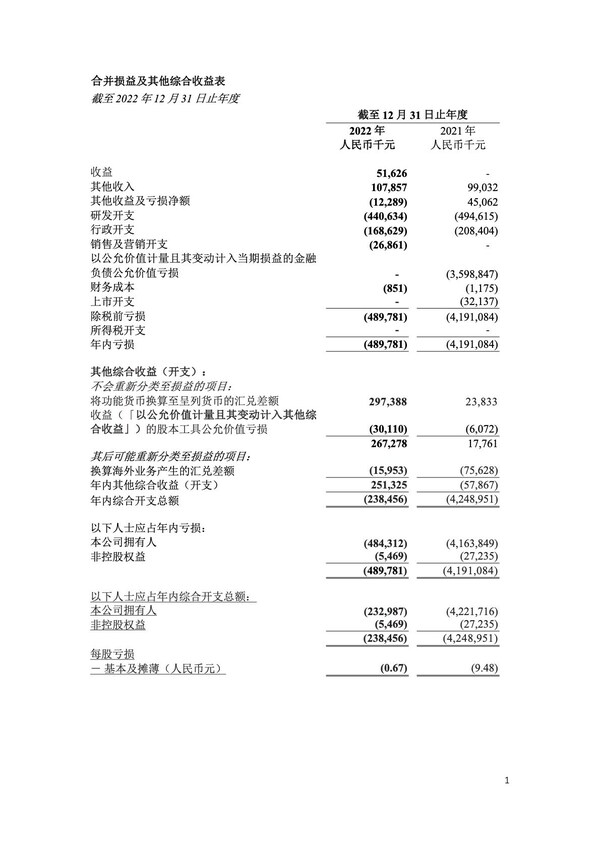
2022年全年財務業績
- 截至2022年12月31日,年度營業收入從零增加至人民幣5,160萬元。該增加是因為用於治療新冠肺炎的長效安巴韋單抗和羅米司韋單抗聯合療法在中國的商業化。
- 截至2022年12月31日,年度其他收入為人民幣1.079億元,較截至2021年12月31日止的人民幣9,900萬元增加人民幣890萬元或9.0%。該增加主要由於全球公開發行股票後銀行及現金結餘的增加而產生的銀行利息收入增加了人民幣3,007萬元。該增加有部分被來自中國政府補助的收入減少所抵消。
- 截至2022年12月31日,年度研發費用為人民幣4.406億元,較截至2021年12月31日止的人民幣4.946億元減少人民幣5,400萬元或10.9%。該減少主要由於與新冠項目有關的第三方合同費用的減少,同時被我們在臨床試驗中持續發展的員工成本的增加部分抵消。
- 截至2022年12月31日,年度銷售和營銷費用從零增加人民幣2,690萬元。該增加主要由於新冠療法的商業化。
- 截至2022年12月31日,年度行政費用為人民幣1.686億元,較截至2021年12月31日止的人民幣2.084億元減少人民幣3,980萬元或19.1%。該減少主要由於員工成本的降低。
- 截至2022年12月31日,年度綜合費用總額為人民幣2.385億元,較截至2021年12月31日止的人民幣42.49億元減少人民幣40.105億元或94.4%。該減少主要由於以公允價值計量且其變動計入當期損益的金融負債的公允價值虧損減少。
電話會議信息
公司將於 2023 年 3 月 24 日,香港時間晚 8:00(美國東部時間上午 8:00)舉行電話會議。在參加電話會議之前,參會者須完成會議註冊。註冊鏈接請點擊這裡。
所有參會者須在電話會議之前使用上述鏈接完成在線註冊。註冊後,每位參會者將收到一封電子郵件,其中包含此次電話會議的重要細節,如電話會議日期、時間和會議鏈接。此鏈接應保密,不得與其他參會者分享。此外,此電話會議的回放將在會議後提供,並可通過訪問公司網站 www.briibio.com 的投資者關係版塊進行獲取。
關於騰盛博藥的項目
乙型肝炎病毒( HBV )(自 VBI 和 Vir授權引進,中國團隊核心項目)
作為公司首要臨床開發項目之一,騰盛博藥正在構建一系列的新型HBV治療候選藥物管線,以提高每個HBV患者亞組達到高水平功能治癒率的可能性。經證實,騰盛博藥的每種HBV候選藥物都擁有獨特的治療模式,可為此種慢性感染帶來臨床獲益,從而使公司可為各種患者亞組探索一套廣泛的潛在聯合治療方案。騰盛博藥擁有在大中華區獨家開發及商業化BRII-179(VBI-2601)、BRII-835(VIR-2218)及BRII-877(VIR-3434)的權益。
BRII-179 (VBI-2601) 是一種基於重組蛋白質的新型HBV 免疫治療候選藥物,可表達Pre-S1 、 Pre-S2 和 S HBV 表面抗原,旨在誘導增強B 細胞和 T 細胞的免疫應答。
BRII-835 (VIR-2218) 是一種靶向所有HBV病毒RNA的 GalNAc偶聯的小干擾核糖核酸(siRNA),其可阻斷HBV的病毒轉錄、減少病毒蛋白並緩解免疫抑制。
BRII-877 (VIR-3434) 是一種皮下注射的研究性HBV單克隆中和抗體,旨在阻斷所有10種基因型的HBV進入肝細胞,並降低血液中病毒顆粒和亞病毒顆粒的水平。BRII-877(VIR-3434)結合了Xencor的Xtend™和其他Fc技術,通過這些改造有希望在感染患者中作為針對HBV的T細胞疫苗,並具有延長的半衰期。
產後抑鬱症(PPD)和重度抑鬱症(MDD)/其他中樞神經系統疾病(自主研發,美國團隊核心項目)
憑借對患者的洞察,騰盛博藥正在開發 BRII-296 和 BRII-297,以擴大精神類疾病患者的治療選擇,這些患者在整個行業中往往得不到充分的治療服務並被忽視。騰盛博藥利用應用藥物配方的專有技術開發長效療法,並致力於提高給藥的便利性和患者依從性,以確保潛在的治療成功。
BRII-296是針對PPD和MDD治療而開發的一種新型、長效、單次注射的治療候選藥物。其作為γ-氨基丁酸A型(GABAA)受體陽性變構調節劑(PAM),旨在快速、顯著和持續地減輕產後抑鬱症的抑鬱症狀,相較於現有護理標準,其有望帶來更好的依從性、便利性和較少的副作用。
BRII-297是我們內部研發的一種新型化學實體(NCE),正在開發作為治療各種焦慮障礙和抑鬱症的長效注射療法。
人類免疫缺陷病毒( HIV)(自主研發,美國團隊項目)
騰盛博藥正在尋求合作夥伴,以共同開發每週一次的單片口服療法BRII-732,用於治療或預防HIV。騰盛博藥還在尋求合作夥伴,以共同開發一種新型低容量皮下注射療法BRII-753。該療法有望每月至每6個月給藥一次。這兩種化合物顯示出相當大的潛力,可以作為長效HIV治療方案的關鍵部分,為HIV感染者提供更謹慎和便利的選擇,並作為HIV預防的單藥療法。
BRII-732是一種專利前藥新化學實體(NCE),經口服後可迅速代謝為EFdA,正作為潛在的HIV治療或預防方案進行評估。BRII-732是一種核甘類逆轉錄酶易位抑制劑(NRTTI),同時起到HIV鏈終止劑和易位抑制劑的作用。
BRII-753是一種當前處於臨床前開發階段的新化學實體。其經內部研發作為一種長效皮下注射劑,或可進行每月一次至每六個月一次給藥。BRII-753可用於HIV治療的聯合療法和PrEP(暴露前預防)的單藥療法。
多重耐藥和廣泛耐藥(MDR/XDR)革蘭氏陰性感染(自 Qpex 授權引進,中國團隊項目)
騰盛博藥正在與合作夥伴 Qpex 合作開發MDR/XDR療法,作為Qpex全球開發計劃的一部分。根據與Qpex簽訂的授權協議,騰盛博藥擁有在大中華區獨家開發及商業化BRII-636、BRII-672和BRII-693的權益。Qpex 正在同時推進 BRII-636 、BRII-672 和 BRII-693 的開發,目標是在騰盛博藥將中國加入其中,作為其全球研究的一部分時,能夠將各項目都推進到全球3期研究。所有 BRII-636 、BRII-672 和 BRII-693 候選藥物都獲得了美國 FDA 授予的 QIDP資格認定,未來可能會獲得更多認可。
BRII-693 (QPX-9003) 是一新型合成脂肽,正在開發用於治療MDR/XDR革蘭氏陰性菌感染。與目前可用的多粘菌素相比,BRII-693結合了增強的體外和體內藥效,以及改善的安全性,有潛力成為院用靜脈注射抗生素的重要補充。
BRII-672 (ORAvance™) 是開發中的BRII-636 的前藥,可通過口服給藥治療MDR/XDR革蘭氏陰性菌感染。該制劑是由Qpex 基於其在BLI領域的專業性而在相關研究中發現,使用了硼原子作為藥理基礎的一部分。
BRII-636 (OMNIvance®) 是一種開發中的靜脈注射新型環狀硼酸衍生的廣譜抑制劑,用於治療MDR/XDR革蘭氏陰性菌感染。
非結核分枝桿菌(NTM)項目(自 AN2 授權引進,中國團隊項目)
騰盛博藥的戰略合作夥伴AN2 Therapeutics正在開發epetraborole(BRII-658),作為慢性NTM肺病患者每天一次的口服療法,最初的開發重點是治療難治性鳥分枝桿菌復合群(MAC)肺病,這是MAC肺病的一種亞型,對新療法有很高的未被滿足的治療需求。騰盛博藥擁有在大中華區開發、製造和商業化 epetraborole(BRII-658)的授權。
BRII-658 (epetraborole) 是一種開發中的用於治療慢性NTM肺病患者的藥物,每天口服一次,最初的開發重點是治療難治性MAC肺病。其為一種含硼、分枝桿菌亮氨酰-轉運核糖核酸(tRNA)合成酶小分子抑制劑,或LeuRS,一種可抑制蛋白質合成的酶。
COVID-19 (由騰盛博藥與清華大學和深圳市第三人民醫院共同成立的子公司騰盛華創醫藥技術(北京)有限公司所共同研發)
安巴韋單抗和羅米司韋單抗是從 COVID-19 康復期患者中獲得的非競爭性新型嚴重急性呼吸系統綜合症病毒 2(SARS-CoV-2)的單克隆中和抗體。特別應用了生物工程技術以降低抗體介導依賴性增強作用的風險,並延長血漿半衰期以獲得更長久的治療效果。
2021 年 12 月長效安巴韋單抗和羅米司韋單抗聯合療法獲中國國家藥監局批准,通過以靜脈輸注,兩種藥物順序給藥的方式,用於治療輕型和普通型且伴有進展為重型(包括住院或死亡)高風險因素的成人和青少年(12-17 歲,體重 ≥40 kg)新型冠狀病毒感染(COVID-19)患者。其中青少年(12-17 歲,體重 ≥40 kg)適應症人群為附條件批准。2023年1月,中國國家衛生健康委員會在《新型冠狀病毒感染診療方案(試行第十版)》及《新型冠狀病毒感染重症病例診療方案(試行第四版)》中重申安巴韋單抗和羅米司韋單抗注射聯合療法。多個獨立實驗室的活病毒和嵌合病毒實驗檢測數據表明,長效安巴韋單抗和羅米司韋單抗聯合療法對常見新冠病毒變異株均保持活性,包括B.1.1.7 (阿爾法, Alpha)、B.1.351 (貝塔, Beta)、P.1(伽馬, Gamma)、B.1.429 (伊普西龍, Epsilon)、B.1.617.2 (德爾塔, Delta)、AY.4.2 (德爾塔+,Delta Plus)、C.37 (拉姆達, Lambda) 、B.1.621 (繆, Mu)、B.1.1.529(奧密克戎, Omicron),以及BA.1.1、 BA.2、 BA.2.12.1、BA.4/5 、BF.7 (奧密克戎亞型變異株)。
本新聞稿涉及第三方信息的引用。此類信息不應被視為參考信息納入本新聞稿中。騰盛博藥對此類第三方信息不負任何責任。
關於騰盛博藥
騰盛博藥(股票代碼:2137.HK)是一家生物技術公司,致力於針對存在巨大未被滿足的患者需求、治療手段有限,以及給患者帶來嚴重社會病恥感的世界最常見的疾病開發創新療法。公司專注於傳染性疾病和中樞神經系統疾病,正在推進一條涵蓋多種獨特候選藥物的產品管線,並通過領先的項目開發針對乙型肝炎病毒(HBV)感染的新型功能性治癒方案,和針對產後抑鬱症(PPD)的首創治療方案。在富有遠見卓識和經驗豐富的領導團隊帶領下,公司在位於羅利-達勒姆、舊金山灣區、北京和上海的主要生物技術中心開展業務。欲瞭解更多信息,請訪問www.briibio.com。
前瞻性聲明
本新聞稿中傳達的信息包含某些具有或可能具有前瞻性的陳述。這些陳述通常包含諸如「將」、「期望」、「相信」、「計劃」和「預期」等詞語以及類似含義的詞語。就其性質而言,前瞻性陳述涉及風險和不確定性,因為它們與事件相關並取決於未來將發生的情況。可能存在目前被認為不重要或公司未意識到的其他重大風險。這些前瞻性陳述並非對未來業績的保證。在這些不確定性的背景下,讀者不應依賴這些前瞻性陳述。前瞻性陳述可能更新或根據未來的事件或發展進行相應修改,對此公司不承擔任何責任。